
官能团差异决定了BEAS-2B细胞摄取14nmPEG-配体金纳米颗粒能力
文章来源:发布时间:2025-03-19 10:33:29浏览数量:
CytoViva是由美国Auburn大学与Aetos技术有限公司合作成立,具有高校和军事公司背景,CytoViva纳米高光谱成像技术最初是由美国国防部和美国宇航局空间卫星航空成像开发的技术发展而来,该公司创造性的将该技术与增强型暗场技术结合并应用于微观层面,使其成为一个专有、集成的系统,能够在纳米尺度上对材料、药物、生命单元、活性大分子、环境污染物等进行高光谱成像及定性定位定量分析。Differences in uptake of 14 nm PEG-liganded gold nanoparticles into BEAS-2B cells is dependent on their functional groups

DOI:10.1016/j.taap.2018.11.014
文献摘要:纳米颗粒的物理化学特征已被证明会改变纳米颗粒的吸收和毒性。这项研究调查了六种金纳米颗粒(AuNPs)进入人支气管表皮细胞系BEAS-2B的吸收。研究的AuNP包括直径为14nm的胶体柠檬酸盐稳定的AuNP;以及通过聚乙二醇(PEG)与功能团结合的14nm AuNPs,即羟基-聚乙二醇(POH)、羟基-聚乙二醇(PCOH)、生物素-聚乙二醇(PBTN)、次氮三醋酸-聚乙二醇(PPTA)和叠氮-聚乙二醇(PAZ)。使用纳米高光谱成像系统通过暗场显微镜观察吸收,并在37 °C下孵育2小时后,在用柠檬酸盐稳定和PCOH AuNPs处理的细胞中观察到吸收。然而,即使在孵育24小时后,也没有观察到POH、PBTN、RNTA或PAZ AuNPs的吸收。对柠檬酸盐稳定化和PCOH AuNPs吸收的能量依赖性的研究表明,吸收是一个活跃的过程。在添加AuNPs之前,用氯喹或染料木黄酮分别作为网格蛋白和小窝介导途径的内吞抑制剂预处理的细胞表明了小窝依赖性的内吞机制。这些结果进一步支持了纳米颗粒细胞内吸收和定位机制以及随后的毒性的发现。
主要观点:
1.14nm金纳米颗粒进入BEAS-2B细胞取决于纳米颗粒表面的官能团。
2.柠檬酸稳定和羧基-聚乙二醇(PCOOH)金纳米颗粒被细胞摄取,而羟基-聚乙二醇、生物素-聚乙二醇、硝基三乙酸-聚乙二醇和叠氮-聚乙二醇金纳米颗粒则未被摄取。
3.柠檬酸稳定和PCOOH金纳米颗粒的摄取是一个主动的、需要能量的过程,涉及到装载小窝的内吞作用。
4.结果突出了理解纳米颗粒表面功能化如何影响细胞摄取和随后的生物效应的重要性。

图3:BEAS-2B细胞与AuNP在37 °C下孵育2小时的暗场图像。细胞以1 nM AuNP处理。以60倍放大率拍摄暗场图像。比例尺=20μm。2个独立实验的2个重复样本的代表性图像。
文中使用了HSI(Hyperspectral Imaging)技术来观察细胞内金纳米颗粒的分布情况。这种无需标记的成像技术可以通过光谱角度映射(Spectral Angle Mapping)的方法,将已知的金纳米颗粒的光谱库与细胞样品的光谱进行匹配,从而确认细胞内是否存在金纳米颗粒。这种方法可以实现对金纳米颗粒摄取的半定量分析,通过计算每个细胞中金纳米颗粒的面积占比来表示摄取量。
结果显示,在37°C下,柠檬酸稳定的金纳米颗粒和PCOOH金纳米颗粒能被细胞摄取,而其他功能化的金纳米颗粒则无法进入细胞。纳米高光谱技术为定量分析金纳米颗粒的细胞摄取提供了一种有效的无需标记的方法。
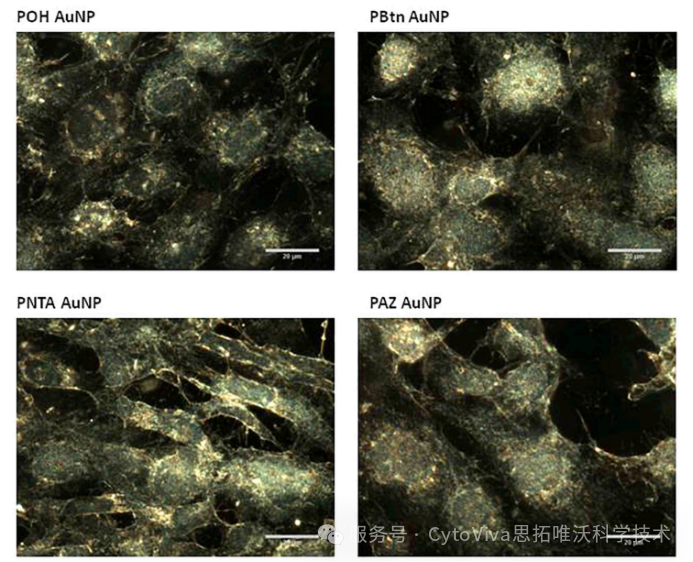
图5:BEAS-2B细胞与AuNP在37 °C下孵育24小时的暗场图像。细胞以1nM AuNP处理。以60倍放大率拍摄暗场图像。比例尺= 20 μm。
图5显示即使在24小时的培养时间内,BEAS-2B细胞也没有摄取POH、PBTN、PNTA或PAZ修饰的金纳米颗粒(AuNPs)。即使将AuNPs浓度提高到5 nM,也没有观察到这些AuNPs的细胞摄取。这表明这些表面修饰的AuNPs在BEAS-2B细胞中的摄取能力非常有限。
全文总结
这项研究调查了六种不同的金纳米颗粒(AuNPs)进入人支气管上皮细胞系BEAS-2B的摄取情况。这些AuNPs包括柠檬酸稳定的AuNPs和通过聚乙二醇(PEG)与各种功能基团结合的14nm AuNPs。结果显示,在2小时的孵育后,观察到柠檬酸稳定的和羧基-PEG(PCOOH) AuNPs的摄取,但在24小时内,羟基-PEG(POH)、生物素-PEG(PBtn)、亚硝酸三乙酯-PEG(PNTA)或叠氮-PEG(PAZ)AuNPs都没有摄取。进一步研究发现,柠檬酸稳定的和PCOOH AuNPs的摄取是一个主动的、需要能量的过程,涉及到囊泡介导的内吞作用。
参考文献:Acharya, S., Hill, R.A., 2014. High efficacy gold-KDEL peptide-siRNA nanoconstructmediated transfection in C2C12 myoblasts and myotubes.

